Российский кардиологический журнал
РОЛЬ БИОМАРКЕРОВ ВОСПАЛЕНИЯ В РАЗВИТИИ ДИСФУНКЦИИ СИНУСНОГО УЗЛА
Василец Л. М., Туев А. В., Хлынова О. В., Вустина В. В., Ратанова Е. А.
Цель. Изучить показатели воспаления у пациентов с различными типами дисфункции синусного узла (ДСУ) и определить возможности их предикторного значения в нарушении функции синусного узла (СУ).
Материал и методы. В исследование включены 83 человека: из них 63 с дисфункцией синусного узла и 20 – группа сравнения. В ходе работы в основной группе были выделены три подгруппы: 1 – пациенты с вегетативной дисфункцией СУ (ВДСУ); 2 группа – больные с синдромом слабости СУ (СССУ) I и II типа и 3 – с синдромом брадикардии-тахикардии (СССУ III тип). У всех обследуемых определяли показатели воспаления, проводили электрофизиологическое исследование сердца и длительное ЭКГ- мониторирование. В качестве показателей воспалительной реакции использовали количественное определение фактора некроза опухоли альфа (ФНО-α), интерлейкина 6 (ИЛ 6) и интерлейкина 4 (ИЛ 4), С реактивного протеина (СРП), фибриногена в сыворотке крови.
Результаты. Дисфункция синусного узла ассоциируется с высоким уровнем ФНО-α и ИЛ 6 в сравнении с практически здоровыми. Концентрация ФНО-α зависит от типа дисфункции синусного узла, максимальное значение наблюдается при синдроме брадикардии-тахикардии. Изменение содержания маркеров воспаления является независимым предиктором возникновения ДСУ: риск возникновения ВДСУ возрастает в 2,5 раза при увеличении концентрации ИЛ 6 более 3 пг/мл, а развитие СССУ при нарастании ИЛ 6 с 2,5 пг/мл до 4 пг/мл становится в 2 раза выше. При повышении уровня ФНО-α более 16 пг/мл возникает риск трансформации СССУ I и II типов в синдром брадикардии-тахикардии в 1,5 раза.
Заключение. Повышенная экспрессия провоспалительных цитокинов при ДСУ может быть связана непосредственно с патогенезом данного аритмологического синдрома.Ключевые слова: дисфункция синусного узла, С реактивный протеин, фибриноген, фактор некроза опухоли альфа, интерлейкин 4 и интерлейкин 6.
ГБОУ ВПО «Пермская государственная медицинская академия им. ак. Е. А. Вагнера» Минздравсоцразвития, кафедра госпитальной терапии № 1, Пермь, Россия.
Василец Л. М. – д.м.н., профессор кафедры, Туев А. В. – д.м.н., профессор, зав. кафедрой, Хлынова О. В. – д.м.н., профессор кафедры, Вустина В. В. – аспирант, Ратанова Е. А.* – аспирант.
*Автор, ответственный за переписку (Corresponding author): lena.ratanova@mail.ru, 614990, г. Пермь, ул. Петропавловская, д. 26.
ВДСУ – вегетативная дисфункция синусного узла, ВРС – вариабельность ритма сердца, ДСУ – дисфункция синусного узла, ИЛ 4 – интерлейкин 4, ИЛ 6 – интерлейкин 6, КВВФСУ – корригированное время восстановления функции синусного узла, НРС – нарушения ритма сердца, СРП – С реактивный протеин, СССУ – синдром слабости синусного узла, СУ – синусный узел. ФВБ – фармакологическая вегетативная блокада. ФНО-α – фактор некроза опухоли альфа, ХСН – хроническая сердечная недостаточность. ЭФИ – электрофизиологическое исследование сердца.
Дисфункция синусового узла (ДСУ) является одним из самых сложных вопросов, связанных с нарушениями ритма сердца (НРС). Значимость этой проблемы обусловлена тем, что ДСУ, по мнению большинства авторов, являясь проявлением общего заболевания проводящей системы сердца, практически всегда сочетается с другими нарушениями ритма и проводимости и, вероятно, усугубляет их, обусловливает рефрактерность к терапии. ДСУ подразделяют на вегетативную дисфункцию синусного узла (ВДСУ), связанную с преобладанием тонуса парасимпатичекого отдела вегетативной нервной системы, синдром слабости синусного узла (СССУ) и электрофизиологическую дисфункцию синусного узла, которая диагностируется только при электрофизиологическом исследовании сердца. Сама по себе ДСУ вызывает значительное снижение «качества жизни» пациентов и представляет угрозу для жизни: известно, что в 10–20% случаев причиной коронарной смерти являются брадиаритмии, а у пациентов с синкопальными состояниями в 15–20% находят СССУ. По данным исследований В. А. Шульмана и соавт., частота СССУ составляет 0,0296%. [1].
Возможность развития аритмии под действием воспалительных маркёров послужила стимулом к целому ряду исследований, посвящённых воспалительной теории аритмогенеза. В настоящее время установлено, что воспалительные процессы способны приводить к нарушению проведения импульсов в проводящей системе сердца, которое впоследствии может обусловить развитие и прогрессирование НРС. Результаты, полученные морфологами, продемонстрировали серьёзный аргумент в пользу данной версии. У лиц, страдающих «идиопатической» фибрилляцией предсердий, при биопсии предсердий были выявлены воспалительные инфильтраты, некрозы миоцитов и фиброз [2]. Установлена роль маркеров воспаления (C реактивного протеина (СРП), фактора некроза опухоли-альфа, фибриногена, интерлейкина 4 и интерлейкина 6) в возникновении и прогрессировании ряда других сердечно-сосудистых заболеваний. Проведены исследования по изучению уровня СРП, фактора некроза опухоли альфа (ФНО-α), интерлейкина 4 (ИЛ 4) и интерлейкина 6 (ИЛ 6) при артериальной гипертонии [3]. У пациентов с артериальной гипертонией уровень СРП и ФНО-α, ИЛ 4 и ИЛ 6 достоверно выше, чем у практически здоровых лиц [4]. Наличие фибрилляции предсердий у пациентов с артериальной гипертонией ассоциировано с высоким уровнем ФНО-α и меньшим уровнем СРП в сравнении с пациентами без аритмии [5]. Установлено, что СРП является независимым предиктором риска сердечно-сосудистых заболеваний [6,7]. В ряде других исследований выявлено, что повышение уровней ФНО-α и ИЛ 6 имеет более важное прогностическое значение по сравнению с СРП для развития сердечно-сосудистой смерти и кардиоваскулярных осложнений [8]. Также в многочисленных работах отражено, что с увеличением ФНО-α прогрессирует дисфункция миокарда [9,10]. Исходя из этих позиций, можно полагать, что показатели воспаления могут быть факторами риска возникновения ДСУ. Возможно, изучение роли сывороточных биомаркеров воспаления в развитии дисфункции синусного узла позволит окончательно расшифровать и детализировать механизмы их патогенеза, что, в свою очередь, позволит понять их комплексное воздействие на организм и получить информацию для создания новых эффективных и безопасных специфических лекарственных средств.
Изложенное выше послужило основанием для определения цели настоящего исследования: изучить показатели воспаления у пациентов с различными типами ДСУ и определить возможности их предикторного значения в нарушении функции синусного узла.
Материал и методы
В исследование было включено 83 человека: у 63 диагностирована ДСУ и 20 составили группу сравнения. Средний возраст пациентов с ДСУ – 29,77±10,57 лет (от 18 до 50 лет), среди них – 49 мужчин (79%) и 14 женщин (21%). В ходе работы в основной группе были выделены три подгруппы: 1 – пациенты с ВДСУ; 2 п/группа – больные с СССУ I и II типа и 3 – с синдромом брадикардии-тахикардии (СССУ III тип).
Группу сравнения составили 20 практически здоровых лиц: 14 мужчин (70%) и 6 женщин (30%), средний возраст – 27,45±8,02 лет, сопоставимых по полу и возрасту с основной группой.
Для формирования более однородных групп были введены критерии исключения: ишемическая болезнь сердца, гипертоническая болезнь, хроническая сердечная недостаточность более II ФК по NYHA, сахарный диабет, нарушение толерантности к глюкозе, бронхиальная астма, некоронарогенные заболевания сердца (кардиомиопатии, миокардиты), пороки сердца, нарушение функции щитовидной железы и острые воспалительные заболевания или обострения хронических воспалительных заболеваний в течение 2 х недель до включения в исследование.
Программа обследования пациентов предусматривала общеклинические и дополнительные методы: общий анализ крови, общий анализ мочи, биохимический анализ крови (общий белок, глюкоза, трансаминазы, креатинин, мочевина, электролиты – Na+, К+, Са2+, Mg2+), липидный спектр крови, гормоны щитовидной железы (ТТГ, Т4 свободный), электрокардиограмма, длительное мониторирование ЭКГ с изучением вариабельности ритма сердца, эхокардиография, тредмил-тест, по показаниям – коронароангиовентрикулография.
Функцию проводящей системы сердца оценивали при проведении электрофизиологического исследования сердца (ЭФИ) методом чреспищеводной электрической стимуляции предсердий с использованием электрокардиостимулятора «Astrocard» и многополюсных электродов ПЭДСП 2 (СКБ г. Каменец-Подольск) по стандартной методике. Исследование проводили в два этапа: на исходном фоне и после фармакологической вегетативной блокады (ФВБ) с помощью внутривенного введения пропранолола в дозе 0,2 мг/кг и атропина 0,04 мг/кг. Для верификации СССУ после ФВБ определяли истинную частоту сердечных сокращений (ЧСС) IHRо, сравнивали ее с должной (IHRр), которую рассчитывали по формуле: IHRр=118,1– (0,57 х возраст)±14% (<45 лет) [±18% (>45 лет)], а также ориентировались на значение корригированного времени восстановления функции синусного узла (КВВФСУо) и, если оно превышало 280 мс, то определяли СССУ.
Помимо электрофизиологических показателей для диагностирования ДСУ использовали клинико-инструментальные критерии: 1) клинические – головокружение, кратковременные потери сознания, перебои в работе сердца, приступы сердцебиения, слабость; 2) ЭКГ (в том числе длительное мониторирование ЭКГ) – ЧСС днем < 40/мин и ЧСС ночью <30/мин (макс. ЧСС <90/мин); синоатриальная блокада или остановка cинусного узла с паузами более 2–2,5 сек; пароксизмы мерцания предсердий или предсердной тахикардии с синусным ритмом <60/мин в межприступном периоде (синдром брадикардии-тахикардии); 3) фармакологические пробы (атропин 0,02 мг/кг) – ЧСС <90/мин и/или прирост ЧСС менее 20% исходного значения, эктопические НРС; 4) пробы с физической нагрузкой (велоэргометрия, тредмил-тест) – при СССУ прирост ЧСС не превышает 20% исходного значения.
В качестве показателей воспалительной реакции использовали количественное определение СРП, фибриногена, ФНО-α, ИЛ 6 и ИЛ 4 в сыворотке крови. Определение СРП проводилось иммунотурбодиметрическим методом с использованием диагностического набора фирмы «Roche-Diagnostics» (Швейцария) на биохимическом анализаторе Cobas Integra 400 plus («Roche», Швейцария). Для оценки уровня ФНО-α, ИЛ 6, ИЛ 4 методом твердофазного иммуноферментного анализа применяли наборы реагентов «альфа-ФНО-ИФА-БЕСТ» код А 8756, «ИЛ 6 ИФА-Бест» код А 8768 и «ИЛ 4 ИФА-Бест» код А 8754 (ЗАО «Вектор-Бест», Новосибирская область, пос. Кольцово). Концентрацию фибриногена в плазме исследовали методом А. Clauss (1957 г.) на автоматическом коагулометре «STA Compact» фирмы «Roche».
Компьютерная обработка статистических данных проводилась с использованием пакета программ Statistica 6,0. Количественные признаки с нормальным распределением представлены как (М±σ). Различия между двумя независимыми группами определяли с использованием U критерия Манна-Уитни и двухвыборочного критерия Колмогорова-Смирнова. Сравнение групп по качественному признаку проводили по точному двустороннему критерию Фишера. Для исследования связи двух признаков вычисляли критерий Спирмена. Статистически значимыми считали различия при р <0,05.
Оценка предикторной ценности показателей воспаления в отношении развития ДСУ проводилась с использованием метода линейной регрессии. При этом первоначально выделялся признак, наиболее тесно связанный с развитием заболевания. Затем был выполнен многофакторный анализ с использованием пошагового подхода. Конечный этап анализа – построение модели прогноза. Для определения эффективности теста рассчитывали его чувствительность (Se), специфичность (Sp), диагностическую точность (ДТ), индекс диагностической эффективности (ИДЭ), прогностичность положительного результата (PVP), прогностичность отрицательного результата (PVN). Так как референтная оценка носила альтернативный характер, а изучаемые тесты давали количественный результат, использовался такой параметр как точка разделения. Точка разделения – величина оптимального сочетания чувствительности и специфичности метода. Превышение этой величины считалось достаточным основанием для качественной оценки. Для этого определяли преваленс (Р), априорные шансы, логарифм правдоподобия, апостериорные шансы.
Результаты и обсуждение
В нашем исследовании показатели воспаления определялись у всех обследуемых (таблица).
Таблица
Показатели воспаления у пациентов с различными типами ДСУ и практически здоровых (М±σ)Примечание: р* – критерий Краскела-Уоллиса, р – критерий Манна-Уитни.
Показатель 1 группа 2 группа 3 группа 4 группа Р1–4* Р ВДСУ СССУ I и II типы СССУ III тип Практически
здоровыеn = 21 n = 20 n = 22 n = 20 СРП, мг/л 1,04±0,87 1,19±0,97 1,86±1,53 1,38±0,84 0,06 Р1–2 =0,8063
Р1–3 =0,0077
Р1–4 =0,1727
Р2–3 =0,0534
Р2–4 =0,3688
Р3–4 =0,3888Фибриноген г/л 2,84±0,85 2,65±1,11 2,96±0,84 3,14±0,45 0,21 Р1–2 =0,5438
Р1–3 =0,7093
Р1-4 =0,1153
Р2-3 =0,3888
Р2–4 =0,0459
Р3–4 =0,2548ФНО-альфа, пг/мл 12,91±8,12 13,52±7,12 22,41±15,89 1,12±0,61 0,00 Р1–2 =0,6702
Р1–3 =0,0492
Р1–4 =0,0000
Р2–3 =0,1351
Р2–4 =0,0000
Р3–4 =0,0000ИЛ-6, пг/мл 11,22±13,13 10,23±12,73 9,39±18,35 2,88±2,47 0,07 Р1–2 =0,9691
Р1–3 =0,8569
Р1–4 =0,1215
Р2–3 =0,6993
Р2–4 =0,0595
Р3–4 =0,0045ИЛ-4, пг/мл 0,97±1,22 0,76±1,08 0,88±1,81 1,02±0,84 0,29 Р1–2 =0,6147
Р1–3 =0,3407
Р1–4 =0,6329
Р2–3 =0,6268
Р2–4 =0,2011
Р3–4 =0,0799Степень повышения маркеров воспаления зависела от типа ДСУ. Максимальная концентрация ФНО-α наблюдалась в подгруппе больных с СССУ III типа (22,41±15,89 пг/мл) по сравнению с пациентами с ВДСУ (12,91±8,12 пг/мл) (р=0,0492) и СССУ I и II типа (13,52±7,12 пг/мл) (р>0,05). Достоверные отличия по уровню ИЛ 6 были зафиксированы у пациентов с CCCУ III типа (9,39±18,35 пг/мл) в сравнении со здоровыми (р=0,0045). При этом отсутствовала разница по величине противовоспалительного цитокина ИЛ 4 во всех обследованных подгруппах: ВДСУ (0,97±1,22 пг/мл), СССУ I и II типа (0,76±1,08 пг/мл) и тип брадикардии-тахикардии (0,88±1,81 пг/мл) (р>0,05). Кроме того, мы не получили статистически значимых различий по маркерам воспаления у больных с СССУ III типа как вне, так и во время пароксизма суправентрикулярных тахиаритмий (р>0,05). Но у пациентов во время пароксизма отмечается тенденция к увеличению уровня СРП (2,26±2,05 мг/л), фибриногена (3,14±0,97 г/л) и ФНО-альфа (27,42±18,27 пг/мл).
Концентрация СРП у всех обследуемых лиц не превышала 5,0 мг/л, что указывало на отсутствие острого воспаления, обострения хронического заболевания и др. По параметру СРП получены лишь достоверные отличия между подгруппами с ВДСУ (1,04±0,87 мг/л) и СССУ III типа (1,86±1,53 мг/л) (р=0,0077). В ряде работ установлено, что повышенный уровень СРП ассоциируется с внезапной смертью [11] и персистирующей фибрилляцией предсердий [12]. В нашем исследовании у пациентов с ВДСУ, СССУ I и II типа по уровню СРП (в пределах 1,0–1,9 мг/л) можно предположить низкий риск сердечно – сосудистых осложнений. Между тем, концентрацию СРП у больных с синдромом брадикардии-тахикардии в интервале от 1,5 до 5,0 мг/л, можно рассматривать как признак вялотекущего воспалительного процесса, связанного с высоким риском сердечно – сосудистых катастроф.
Не получено различий концентрации фибриногена у обследуемых с ВДСУ (2,84±0,85 г/л) и при СССУ III типа (2,96±0,84 г/л) (р>0,05). В подгруппе с СССУ I и II типа уровень фибриногена достоверно ниже по сравнению с практически здоровыми (2,65±1,11 г/л, р=0,0459). Величина фибриногена во всех обследованных подгруппах находилась в диапазоне от 1,8 до 4 г/л, что также исключало острую фазу воспаления.
Таким образом, при ВДСУ и СССУ I и II типа показатели воспаления (фибриноген, СРП, ФНО-α, ИЛ 6 и ИЛ 4) достоверно не отличаются по величине. При синдроме брадикардии-тахикардии наряду с повышением ФНО-α и ИЛ 6 прослеживается тенденция к увеличению уровней фибриногена и СРП, что, возможно, связано с наличием пароксизмальных нарушений ритма сердца. Полученные результаты позволяют предположить, что нарушение проводимости и автоматизма в меньшей степени обусловлено повышением маркеров воспаления, нежели эктопическая активность миокарда, что подтверждается данными других исследований [13,14].
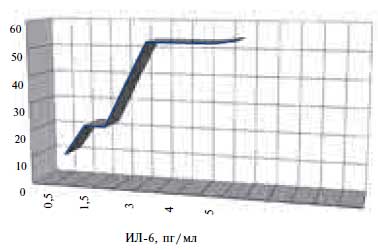
При проведении статистической обработки материала были найдены достоверные различия между показателями воспаления в зависимости от типа ДСУ. Установленные особенности стали основой для оценки прогностической значимости маркеров воспаления в отношении развития ДСУ. Построение модели прогноза возникновения ВДСУ выполнено на 41 пациенте: 21 – больные ВДСУ и 20 – практически здоровых. В многофакторный регрессионный анализ были включены данные по полу, уровню СОЭ и лейкоцитов, фибриногена, СРП. Независимым предиктором возникновения ВДСУ оказался ИЛ 6 (F=1,87, р=0,02). Модель прогноза имеет вид: Y = – 0,3443 + 0,18450 × Х1, где: Y – показатель прогноза, – 0,3443 – константный показатель, Х1 – значение ИЛ 6 (пг/мл). При расчете диагностической эффективности зарегистрировано, что при повышении ИЛ 6 более 3 пг/мл риск развития ВДСУ становится в 2,5 раза выше (чувствительность – 52%, специфичность – 45%, ИДЭ – 48,7%) (рис. 1).
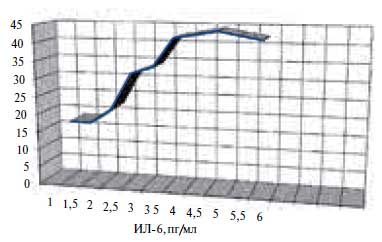
Рис. 1. Прогнозирование возникновения вегетативной дисфункции синусного узла по уровню ИЛ 6.Построение модели прогноза формирования СССУ выполнено на 62 пациентах: 42 – больных СССУ и 20 – практически здоровых. В многофакторный регрессионный анализ были включены данные по полу, ИМТ, уровням СОЭ и лейкоцитов, значению СРП. Независимым предиктором возникновения СССУ оказался ИЛ 6 (F = 1,89, р = 0,0001). Модель прогноза имеет вид: Y = 3,4409 + 0,32260 × Х1, где: Y – показатель прогноза, 3,4409 – константный показатель, Х1 – значение ИЛ 6 (пг/мл). При расчете диагностической эффективности выявлено, что при увеличении ИЛ 6 с 2,5 пг/мл до 4 пг/мл риск развития СССУ становится в 2 раза выше (чувствительность – 31–2%, специфичность – 30–45%, ИДЭ – 35,5–38,7%) (рис. 2).
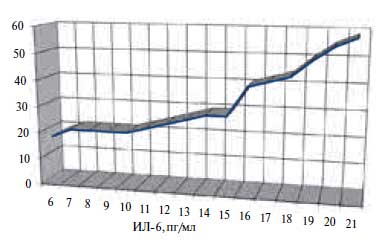
Рис. 2. Прогнозирование возникновения синдрома слабости синусного узла по уровню ИЛ 6.Построение модели прогноза возникновения суправентрикулярных тахиаритмий при СССУ выполнено на 42 пациентах: 20 – СССУ I и II типа, 22 – СССУ III типа. При унивариантном регрессионном анализе предикторная ценность выявлена в отношении показателя ФНО-α (F=5,29 при р=0,0000). В многофакторный регрессионный анализ были включены данные по полу, индексу массы тела (ИМТ), уровню СОЭ и лейкоцитов, фибриногена, ИЛ 4, размеров ЛП и др. ФНО-α сохранил свою предикторную ценность в отношении развития суправентрикулярных тахиаритмий (F =1,37, p=0,0002). Модель прогноза имеет вид: Y= – 0,6509 + 0,08960 × Х1, где: Y – показатель прогноза, – 0,6509 – константный показатель, Х1 – значение ФНО-α (пг/мл). При расчете диагностической эффективности обнаружено, что при увеличении ФНО-α более 16 пг/мл риск возникновения суправентрикулярных тахиаритмий при СССУ становится в 1,5 раза выше (чувствительность – 41%, специфичность – 40%, ИДЭ – 40,5%) (рис. 3).
Рис. 3. Прогнозирование развития суправентрикулярных тахиаритмий при синдроме слабости синусного узла по уровню ФНО-альфа.Заключение
Резюмируя полученные данные, можно предположить, что повышенная экспрессия провоспалительных цитокинов при ДСУ может быть связана непосредственно с патогенезом данного аритмологического синдрома. Полученные результаты позволили обозначить независимую предикторную ценность ИЛ 6 в отношении риска развития ВДСУ и СССУ, а также ФНО–α в возникновении риска суправентрикулярных тахиаритмий у пациентов с синдромом слабости синусного узла. Предложенные количественные критерии уровня ФНО–α и ИЛ 6 могут обеспечить раннюю диагностику дисфункции синусного узла.
Литература
- Shul, man V. A., Nikulina S.Ju., Matjushin G.V Idiopathic (primary) diseases of spending system of heart. Kardiologija 2000; № 1: 89–92. Russian (Шульман В. А., Никулина С. Ю., Матюшин Г. В. и др. Идиопатические (первичные) заболевания проводящей системы сердца. Кардиология 2000; № 1:89–92).
- Strain J. Results of endomyocardinal byopsy in patients with spontaneous ventricular tachycardia but without apparent structural heart disease. Circulation 2001; Vol.104:2886–2891.
- Vasilec L. M., Tarasova O. A. СRP and the FNO-Alpha at fibrillation of auricles. Aktual’nye voprosy klinicheskoj mediciny. Perm, 2005;146–150. Russian (Василец Л. М., Тарасова О. А. СРП и ФНО-альфа при фибрилляции предсердий. Актуальные вопросы клинической медицины. Пермь, 2005;146–150).
- Kobalava Zh. D., Kotovskaja Ju. V., Dogotar’i O. A. i dr. Characteristic of a subclinical inflammation at patients with not complicated arterial hypertension. Arterial hypertensia 2006; № 3 (Vol.2):216–221 Russian (Кобалава Ж. Д., Котовская Ю. В., Доготарьи О. А. и др. Характеристика субклинического воспаления у больных с неосложненной артериальной гипертонией. Артериальная гипертензия 2006; № 3 (2 том):216–221).
- Tarasova O. A. A role of markers of an inflammation at fibrillation of auricles. “Vrach-aspirant”. Voronezh, 2007; 1 (16):49–53. Russian (Тарасова О. А. Роль маркеров воспаления при фибрилляции предсердий. «Врач-аспирант». Воронеж, 2007; 1 (16):49–53).
- Nasonov E. L., Panjukova E. V., Aleksandrov E.N C reacrive protein – an inflammation marker at an atherosclerosis (the new data). Cardiology 2002; № 37:53–62. Russian (Насонов Е. Л., Панюкова Е. В., Александров Е. Н. С реактивный белок – маркер воспаления при атеросклерозе (новые данные). Кардиология 2002; № 37:53–62).
- Rosen B. D., Cushman M, Nasir K, et al. Relationship between C reactive protein levels and regional left ventricular function in asymptomatic individuals: the Multi-Ethnic Study of Atherosclerosis. J Am Coll Cardiol 2007; 49:594–600.
- Lee KWJ, Hill JS, Walley KR et al. Relative value ofmultiple plasma biomarkers as risk factors for coronary arterydisease and death in an angiography cohort. CMAJ 2006; 174:461–466.
- Rauchaus M., Clark A. L., Doehner W. et al. The relationship between cholesterol and survival in patients with chronic heart failure. J Am Coll Cardiol 2003;42:1933–1944.
- Adamjan K. G., Azarapetjan L. G., Grigorjan S. V. Role of a latent inflammation in patogenese fibrillations of auricles. Vestnik aritmologii, 2008; 54:34–41. Russian (Адамян К. Г., Азарапетян Л. Г., Григорян С. В. Роль латентного воспаления в патогенезе фибрилляции предсердий. Вестник аритмологии 2008; 54:34–41).
- Albert CM, Ma J, Rifai N et al. Prospective study of C reactive protein, homocysteine, and plasma lipid levels as predictors of sudden cardiac death. Circulation 2002; 105:2595–9.
- Chung MK, Martin DO, Sprecher D, et al. C reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001; 104:2886–91.
- Acevedo M, Corbalan R, Braun S et al. C reacrive protein and atrial fibrillation: evidence for the presence of inflammation in the perpetuation of the arrhythmia. Int. J Cardiolog. 2006; 14,108 (3):326–331.
- Aviles R. J., Martin D. O., Apperson-Hansen C. et al. Inflammation as a rick factor for atrial fibrillation. Circulation 2003; 108 (24):3006–3010.
BIOMARKERS ROLE IN THE DEVELOPMENT OF SINUS NODE DYSFUNCTIOn
Vasilets L. M., Tuev A. V., Khlynova O. V., Vustina V. V., Ratanova E. A.
Aim. In patients with different types of sinus node dysfunction (SND), to study inflammation marker levels and assess their value as predictors of SND development.
Material and methods. The study included 83 individuals: 63 patients with SND (the main group) and 20 controls. The main group was divided into three subgroups: Subgroup 1, with vegetative SND (VSND); Subgroup 2, with Type I and II sick sinus syndrome (SSS); and Subgroup 3, with tachy-brady syndrome, or Type III SSS. In all participants, the measurement of serum levels of inflammation markers, cardiac electrophysiological testing, and long-term electrocardiography monitoring were performed. The inflammation markers of interest included tumour necrosis factor alpha (THF-α), interleukin (IL) 6, IL-4, C-reactive protein (CRP), and fibrinogen.
Results. Compared to controls, SND patients were characterised by increased levels of TNF-α and IL-6. TNF-α concentration was linked to SND type, with the highest levels observed in patients with tachy-brady syndrome. Elevated levels of inflammation markers independently predicted SND development. In particular, VSND risk was 2,5 times higher in patients with IL-6 concentration >3 pg/ml. SSS risk doubled when the levels of IL-6 increased from 2,5 pg/ml to 4 pg/ml. TNF-α levels >16 pg/ml were associated with a 1,5-fold increase in the risk of Type I-II SSS transformation into tachy-brady syndrome.
Conclusion. Increased expression of inflammation cytokines in SND patients could be directly linked to pathogenetic mechanisms of this arrhythmic syndrome.Russ J Cardiol 2012, 2(94): 43–48
Key words: Sinus node dysfunction, C-reactive protein, fibrinogen, tumour necrosis factor alpha, interleukin-4, interleukin-6.
Academician E. A. Wagner Perm State Medical Academy, Hospital Therapy Department No. 1, Perm, Russia.